“Molecule of the Week” layihəsi çərçivəsində Xəyalə Kəsəmənli tərəfindən yazılan məqalə: “Ferrosen”.
Ferrosen-metalüzvi birləşmələr içərisində ən geniş yayılmış, sendviç birləşmələr sinfinin nümayəndəsidir. Nomenklatur adı: bis- η5-dəmir(II)tsiklopentadienil (η5-С5Н5)2Fe. Narıncı kristallardır. Ferrosen atmosfer təzyiqində qovulur; üzvi həlledicilərdə həll olur, suda həll olmur, havanın təsirinə, qaynar duru xlorid turşusuna və qələvi məhlullarına qarşı davamlıdır.
Molekulyar formulu: C10H10Fe
Molyar kütləsi: 186,04 q/mol
Tərimə=172,5 0C
Sıxlığı: 1,11 q/sm3
Tqaynama=249 0C
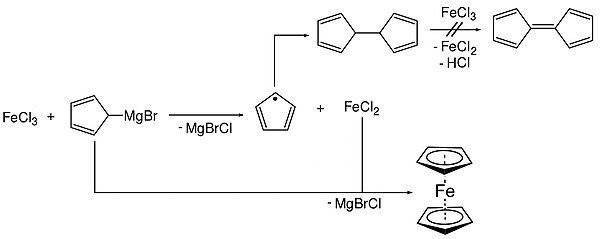
Kəşfi: 1951-ci ildə T. Kili və P. Poson yeni karbohidrogen-ditsiklopentadienil sintez etmək üçün C5H5MgBr ilə dəmir(III)xlorid Fe(Cl)3 arasında reaksiya aparmışlar. Gözlənilmədən onlar tərkibində dəmir olan davamlı sarı-narıncı kristal birləşmə aldılar. Onun quruluşunu başa düşmək üçün bir ilə yaxın vaxt getdi. Məlum oldu ki, dəmir atomu iki simmetrik beşüzvlü həlqələrlə bağlanmışdır. Molekulda beşüzvlü həlqələr həlqələrin mərkəzini birləşdirən ox ətrafında sərbəst fırlanırlar. Bu tip quruluşa “sendviç” quruluş deyilir. Reaksiya qabiliyyətliliyi benzola bənzədiyi üçün yeni birləşməyə “ferrosen” adı verildi. Ferrosenin quruluşu, 1952-ci ildə reaksiya qabiliyyətinə əsaslanaraq R. Vudvord və C. Uilkinson tərəfindən və onlardan asılı olmayaraq rentgenostruktur məlumatlara əsaslanaraq E. Fişer tərəfindən verilmişdir.
Ferrosen-diamaqnitdir, dipol momentinə malik deyil, Ferrosen 400 0C-də təsirsiz qalır. Qələvi və turşulara qarşı da davamlıdır. Turşu oksidləşdiricilərin təsirindən davamsız, tünd göy rəngində [(C5H5)2Fe]+ kation əmələ gətirir.
Alınması:
- Dəmir(III)xloridin Qrinyar reaktivi ilə reaksiyasından:
2. Tsiklopentadienlə dəmir-pentakarbonilin reaksiyasından:
Fe(CO)5 + 2 C5H6(g) → Fe(C5H5)2 + 5 CO(g) + H2(g)
3. Dəmir(II)xloridlə tsiklopentadien və dietilaminin qarşılıqlı təsirindən:
FeCl2 + 2 C5H6 + 2 (C2H5)2NH → Fe(C5H5)2 + 2 (C2H5)2NH2Cl
Kimyəvi xassəcə ferrosen, benzoldan daha aromatik maddədir. Belə ki, o, elektrofil əvəzlənməyə daha çox meyillidir və birləşmə reaksiyalarına çətin daxil olur.
Ferrosen üçün xarakterik əvəzlənmə reaksiyaları Fridel-Kraftsa görə asilləşmə, sulfolaşma, fenilnatriumla və butillitiumla metallirləşmə hesab olunur. Ferrosen üçün nukleofil reaksiyalar xarakterik deyil.
Tətbiqi: Ferrosen, neft sənayesində antidenator kimi istifadə olunur. Dien kauçuklarının və polietilenin termostabilizatoru kimi istifadə edilir. Bəzi tibbi preparatların sintezində istifadə olunur. Antitümör və antibiotik aktivliklər göstərir.
Ədəbiyyat:
- Ferrocene – Wikipedia
- Л.Физер, М.Физер/Органическая химия/Москва 1970.