“Molecule of the Week” layihəsi çərçivəsində Tuncay İmanlı tərəfindən yazılan məqalə: “Tetraboran”.
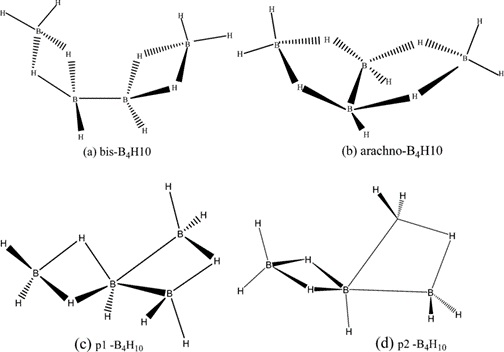
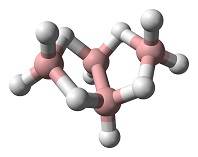
B4H1o kimyəvi formuluna malik tetraboran sabit bor-hidrogen birləşmələrindən biridir. 1912-ci ildə Stock və Messenez tərəfindən təsnif edilən ilk bor hidrid birləşməsidir və ilk dəfə Alfred Stock tərəfindən ayrıca öyrənilmişdir. Digər boranlar kimi, tetraboranın quruluşu da hidrogen körpüləri və ya protonlaşmış ikiqat rabitələrlə bağlıdır. Wade qaydalarına rasional olaraq kəpənək həndəsəsinə malikdir. Hər bir bor sp3 hibridləşməsindədir. I və III yerdə dayanan borları əhatə edən üç hidrogenin konfiqurasiyası üçbucağa bənzər şəkildədir və bu quruluşa əsasən təxminən 120 ° rabitə bucağına malik tetraedral hibridizasiya təklif edilir.
Bor hidridləri quruluşundakı diborane (B2H6), tetraboran (B4H1o), pentaboran (B5H11) bor atomlarının sayına görə adlandırılır.
Tetraboran bor hidridlərinə xarakterik olan küf qoxusuna malik rəngsiz, zəhərli qazdır. -120 0C-də əriyib, 16 0C-də qaynayır. Benzolda asanlıqla həll olur, 0 0C-dən aşağı temperaturda sabitdir.
Su ilə hidrolizindən bor turşusu, hidrogen alınır:
B4H10 + 12 H2O → 4 B(OH)3 ↓ + 11 H2 ↑
Otaq temperaturunda bir neçə saat ərzində digər boranlara parçalanır (yüksək temperaturda parçalanma daha sürətli gedir):
B4H10 → B2H6 – B5H9 – B10H14 – (BH)n
100 °C-ə qədər əsasən hidrogen, diboran və pentaboran-9, daha yüksək temperaturda isə hidrogen, pentaboran-9, heksaboran və borla zəngin hidridlərə parçalanır.
Qələvi məhlullarla reaksiyası: B4H10 + 4 NaOH → 4 Na[B(OH)4] + 11 H2 ↑
Qızdırıldıqda ammonyakla reaksiyaya daxil olur: 3 B4H10 + 12 NH3 → 4 B3H6N3 + 21 H2 (200 0C,P)
Havada öz-özünə alovlana bilər: 2 B4H10 + 11 O2 → 4 B2O3 + 10 H2O
Xlorla reaksiya: 2 B4H10 + 17 Cl2 → 8 BCl3 + 10 HCl
Asan oksidləşdiyi üçün vakuum altında saxlanılmalıdır. Tetraboran hava, oksigen və nitrat turşusu ilə təmasda olduqda alovlanır. Boranlar ümumiyyətlə tetraboran da daxil olmaqla çox zəhərli sayılır və bioloji cəhətdən dağıdıcıdır. Bu qrup birləşmələr mərkəzi sinir sistemini zədələyir. Bu kimyəvi maddənin dovşanlara və siçovullara gündəlik kiçik miqdarda təsirini əhatə edən bir araşdırma canlıların ölümüylə nəticələnmişdir.
Alınması:
1955-ci ildə B2H6 (diboran) pirolizi ilə sintez edilmişdir. Tetraboran, turşuların maqnezium, alüminium və ya berilium boridlərə təsiri, maqnezium boridin hidrolizi, yüksək temperaturda və ya elektrik boşalmasında bir bor halogenidin hidrogenləşməsi kimi müxtəlif üsullarla alına bilər.
Maqnezium boridin hidrolizi yüksək tetraboran (14%) məhsulu verən reaksiyalardan biridir.
Yoddiboranın natrium ilə reaksiyasından da əldə etmək mümkündür:
2B2H5J + 2Na B4H10 +2NaJ
Fosfat turşusunun maqnezium boridə təsiri:
Mg3B2 + H3PO4 B4H10 + Mg3(PO4)2 ↓
Tətbiqi:
Boranlar hidrogenlə zəngin olduqları üçün enerji xammalı olaraq istifadə olunur. Boranlardan tetraboran (B4H10) raketlərdə bərk yanacaq olaraq istifadə olunur. Bu səbəbdən kosmik tədqiqatlarda strateji əhəmiyyətə malikdir. Xüsusilə ölkəmizdə bor raketlərdən bərk yanacaq olaraq istifadə olunur. Ölkəmizdəki bor ehtiyatını nəzərə alsaq, bor birləşmələrinin ölkəmizin iqtisadiyyatı baxımından nə qədər önəmli olduğunu göz ardı etmək olmaz.
Ədəbiyyat:
- https://pubs.acs.org/doi/abs/10.1021/ba-1961-0032.ch009
- https://kimyaca.com/bor-bilesiklerinin-ozellikleri-ve-kullanim-alanlari/
- https://www.worldofchemicals.com/chemicals/chemical-properties/tetraborane.html
- https://stringfixer.com/tr/Tetraborane
- https://chem.ru/tetraboran.html