“Molecule of the Week” layihəsi çərçivəsində Günel Cavadzadə tərəfindən yazılan məqalə: “Flüorsulfon Turşusu”.
Təbiətdə tapılması və kəşfi:
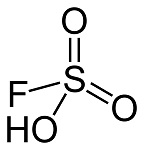
Flüorsulfon turşusu HSO3F kimyəvi formuluna malik qeyri-üzvi mürəkkəb quruluşlu turşudur. O, 19-cu əsrin sonlarından bəri məlum olan son dərəcə güclü Bronsted turşularındandır. Ona sanki flüorlu sulfat turşusu kimi də baxa bilərik, lakin saf sulfat turşusundan 1000 qat güclüdür və bu da onu super güclü turşular sinfinə daxil edir. Belə ki, 100%-li sulfat turşusundan güclü turşulara super turşular deyilir. Flüorsulfonun turşuluğu yüksək konsentrasiyalı oleumla (H2SO4·SO3) müqayisə oluna bilər, lakin dayanıqlılığı, asan təmizlənməsi, geniş maye intervalı və özlülülüyünün az olması, həmçinin zəif oksidləşmə qabiliyyəti onu istifadəyə daha yararlı edir.
Fiziki və kimyəvi xassələri:
Flüorsulfon turşusu sərbəst axan rəngsiz bir mayedir. Üzvi həlledicilərdə (məsələn, nitrobenzol, sirkə turşusu və etil asetat) həll olur, lakin alkanlar kimi polyar olmayan həlledicilərdə az həll olur. Molyar kütləsi 100.06 q · mol -1 -dir. Sıxlığı 1.726 q sm-3 -dir. Ərimə nöqtəsi -87.5 °C; qaynama nöqtəsi 165.4 °C-dir.
Bu qüvvətli turşu əsaslarla (məsələn: aminlər, amidlər və qeyri üzvi əsaslarla) reaksiyaya girir və proses ekzotermikdir. Bu tip reaksiyalar nəticəsində kiçik sahədə çox böyük miqdarda istilik yarana bilir ki, bu da olduqca təhlükəlidir. Su ilə şiddətli şəkildə reaksiyaya daxil olub hidrogen flüorid və sulfat turşusu əmələ gətirir. Alüminium və dəmir də daxil olmaqla aktiv metallarla reaksiyasından yanıcı qaz olan hidrogen ayrılır. Alkenlərin polimerləşməsinə təkan verə bilər. Sianid birləşmələri ilə reaksiyasından hidrogen sianid ayrılır. Ditiokarbamatlar, izosianatlar, merkaptanlar, nitridlər, nitrillər, tiosulfatlar və digər güclü reduksiyaedicilərlə qarşılıqlı təsiri nəticəsində yanıcı və zəhərli qazlar əmələ gəlir. Katalizator kimi kimyəvi reaksiyaların sürətini artıra bilər.
Əsas alınma üsulu:
Flüorsulfon turşusu HF (flüorid turşusu) və kükürd trioksidin reaksiyası ilə hazırlanır:
SO3 + HF → HSO3F
Alternativ olaraq, 250 °C temperaturda KHF2 və ya CaF2-nin oleumla reaksiyası aparıla bilər. İnert qaz vasitəsilə HF-dən ayırdıqdan sonra, şüşə aparatda distillə edilə bilər.
Tətbiqi:
Flüorsulfon turşusu HF və H2SO4 qarışığını bərpa etməklə qurğuşun şüşəsinin aşındırılmasında faydalı rol oynayır. HSO3F alkanları və karbohidrogenlərin alkenlərlə alkilləşmə məhsulunu izomerləşdirir, lakin belə tətbiqlərin kommersiya əhəmiyyəti tam aydın deyil. Laboratoriyada floridləşdirici vasitə kimi də istifadə edilə bilər.
Maraqlı faktlar:
Flüorsulfon turşusu çox zəhərli və son dərəcə aşındırıcı hesab olunur. Hidroliz edərək HF-i sərbəst buraxır. HSO3F-ə su əlavə etmək, sulfat turşusuna su əlavə edilməsinə bənzəyir, lakin daha şiddətli və təhlükəli ola bilər.
Ədəbiyyat:
- https://www.chemeurope.com/en/encyclopedia/Fluorosulfuric_acid.html
- https://cameochemicals.noaa.gov/chemical/765
- Olah, George A., et al. “Friedel–Crafts Alkylations.” Comprehensive Organic Synthesis, 1991, pp. 293–339
- Fluorosulfuric acid – Wikipedia
- Fluorosulfuric acid-d | FHO3S – PubChem (nih.gov)